![]()
![]()
| A Destilação Fracionada é empregada quando a diferença entre os pontos de ebulição dos líquidos da mistura é menor do que 80oC. Um aparelho mais sofisticado e um pouco mais de tempo são necessários. |
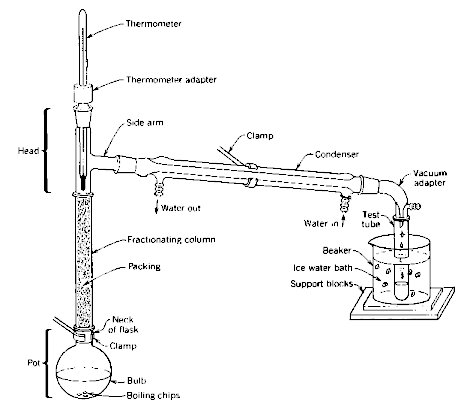
|
| A principal diferença no aparelho de destilação fracionada é a presença de uma coluna de fracionamento. O objetivo desta coluna é criar várias regiões de equilíbrio líquido-vapor, enriquecendo a fração do componente mais volátil da mistura na fase de vapor. |
|
Lei de RAOULT Quando dois líquidos infinitamente miscíveis são postos juntos, a pressão de vapor de cada um é reduzida pela pressão de vapor do outro; cada componente em uma solução contribui proporcionalmente a sua fração molar na mistura. A pressão total de vapor é igual a soma das pressões de vapor exercidas por cada componente, na mistura. |
Lei de Raoult: PA=XAPAo |
|
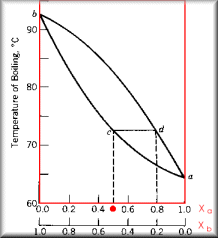
Diagrama de Fase
A composição da fase do vapor não é, necessariamente, igual a da fase líquida; o vapor uma fração do componente mais volátil maior do que no líquido. A figura ao lado representa um diagrama de fase para uma mistura entre o líquido b (p.e.=92,5oC) e líquido a (p.e.=65oC). Segundo o diagrama, uma solução cuja composição é de Xa=Xb=0,5 entra em ebulição a 72,5oC (ponto c). Pela figura, vemos que o ponto em equilíbrio líquido-vapor (ponto d) reflete uma composição de Xa=0,8, ou seja, o vapor apresenta uma fração de a maior do que no líquido. Este é o princípio da destilação fracionada: diversas "destilações" são conduzidas na coluna de fracionamento, e o vapor vai se enriquecendo com o componente mais volátil. |
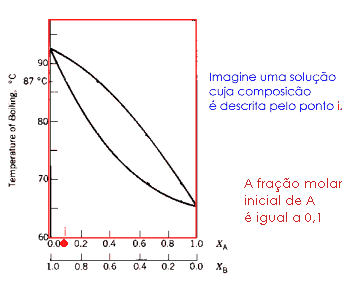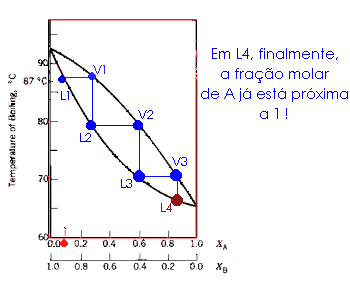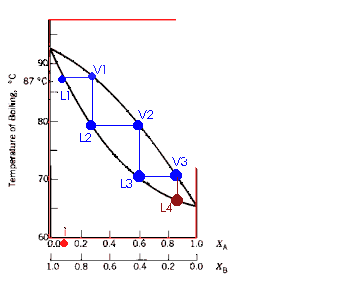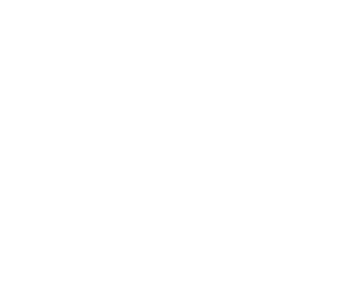
|
A animação ao lado ilustra a destilação de sucessivas frações: esta é a destilação fracionada! |
|
Destilando Frações Na coluna de fracionamento, acontece o mesmo fenômeno: sucessivas destilações são realizadas, e o vapor vai se enriquecendo com o componente mais volátil. |
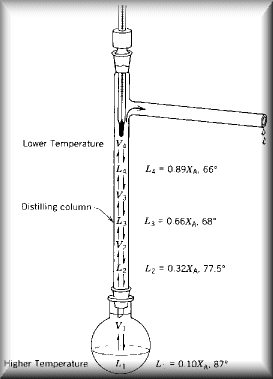
|
| Azeótropos |
| Certos líquidos formam, em uma determinada composição, uma mistura com ponto de ebulição constante - não podem ser separados por destilação. O termo foi criado por Wade e Merriman, em 1911, para designar todas as misturas binárias e ternárias que não podiam ser separadas por destilação. Um bom exemplo de azeótropo é a mistura entre álcool etílico e água: o álcool 96 GL que é vendido nos supermercados! |
|
|
|